Исследование CRASH-2, опубликованное в 2010 году, показало улучшение выживаемости пациентов с травматическим кровотечением, получавших ТХА, по сравнению с плацебо. Благодаря этим данным, TXA стал стандартной практикой во многих условиях. Однако пациенты со значительной травмой головы были исключены из этого исследования, и было неясно влияние ТХА в этой группе. В 2019 году CRASH-3 изучил использование TXA при черепно-мозговой травме (TBI) и обнаружил, что общий размер эффекта TXA на ICH не был статистически значимым по сравнению с плацебо. Анализ подгрупп показал, что у некоторых пациентов.

Что они сделали:
- Рандомизированное, многоцентровое, двойное слепое, трехгрупповое, клиническое испытание фазы II во внебольничных условиях в течение 2 часов после травмы.
- 12 центров, 20 травматологических центров и 39 сервисных центров EMS в США и Канаде.
- Рандомизировано для:
- Группа поддержания болюса: Внебольничный болюс TXA 1 г и внутрибольничная инфузия TXA 1 г 8 часов
- Группа только болюса: вне больницы болюс TXA 2 г и 8-часовая инфузия плацебо в больнице.
- Группа плацебо: болюсное введение плацебо вне больницы и 8-часовая инфузия плацебо в стационаре.
- Первичная: благоприятная неврологическая функция в 6 месяцев.
- Расширенная оценка по шкале результатов Глазго 4 = умеренная инвалидность или хорошее восстановление.
- Пороги значимости установлены на уровне 0,1 для пользы и 0,025 для вреда.
- Дополнительный:
- 18 вторичных конечных точек, 5 из которых сообщили о статистическом анализе в этой статье.
- 28-дневная смертность
- Оценка по шкале оценки инвалидности за 6 месяцев
- 0 = нет инвалидности
- 30 = смерть
- Прогрессирование ВЧК (определяется как увеличение совокупного объема на 33%).
- Заболеваемость судорогами.
- Частота тромбоэмболических осложнений.
- Возраст ≥15 лет
- Тупая или проникающая ЧМТ средней или тяжелой степени (GCS 3–12).
- Как минимум один реактивный ученик.
- САД не менее 90 мм рт. ст. до рандомизации.
- Внутривенный катетер установлен, и исследуемый препарат можно ввести в течение 2 часов после травмы.
- Предварительно определенным пунктом назначения скорой помощи был травматологический центр.
- Догоспитальные GCS = 3 без реактивного зрачка.
- Расчетное время от травмы до начала болюса исследуемого препарата 2 ч.
- Пациенты с САД
- Неизвестное время травмы.
- Клиническое подозрение на судорожную активность, острый инфаркт миокарда или инсульт, или наличие известного анамнеза, насколько это возможно, на судороги, тромбоэмболические нарушения или почечный диализ.
- СЛР в EMS до рандомизации.
- Ожоги 20% общей площади тела.
- Подозреваемые или известные заключенные.
- Предполагаемая или известная беременность.
- Назначение догоспитального ТХА или другого прокоагулянта перед рандомизацией.
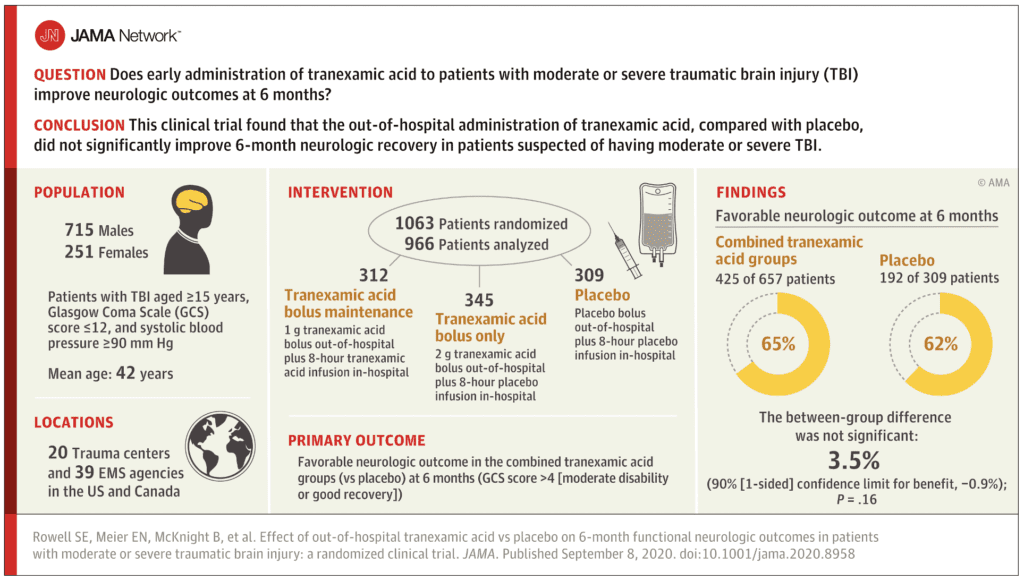
- 1063 пациента были рандомизированы.
- 966 участников в популяции анализа
- Средний балл по GCS = 8.
- Среднее время от травмы до введения исследуемого препарата вне больницы варьировалось от 40 до 43 минут в разных группах.
- 28 летальных исходов от всех причин = 16% (из которых 87% были связаны с неврологическими повреждениями).
- 819 (84,8%) участников доступны для первичного анализа результатов через 6 месяцев наблюдения.
- Благоприятная неврологическая функция через 6 месяцев:
- Группы TXA: 65%
- Группа плацебо: 62%.
- Разница -3,5%
- Не имеет статистической значимости.
- Отсутствует статистически значимая разница в 28-дневной смертности между группами (14% против 17%), баллах по шкале оценки инвалидности (6,8 против 7,6) или прогрессирование ICH (16% против 20%)
- 28-дневная смертность:
- Только болюс: 12,0%
- Поддержание болюса: 17,0%
- Скорректированная разница для поддерживающего болюса и плацебо: -0,09%; 95% ДИ от -6,1% до 5,9%; р = 0,98
- Скорректированная разница только для болюса и плацебо: -5,4%; 95% ДИ от -10,9% до 0,05%; р = 0,05
- Скорректированная разница только для болюса и поддерживающего болюса: -5,3%; 95% ДИ от -10,8% до 0,1%; р = 0,06
- Неблагоприятные события:
- Тромботические события:
- Только болюс: 9%
- Поддержание болюса: 4%
- Плацебо: 10%
- Судорожные припадки:
- Только болюс: 5%
- Поддержание болюса: 2%
- Плацебо: 2%
- Тромботические события:
- Многоцентровое рандомизированное двойное слепое клиническое испытание
- Среднее время от травмы до исследуемого препарата было коротким (т. е. ≈40 минут).
- Групповые задания были закрыты для всех агентств EMS, фармацевтов, координаторов и поставщиков медицинских услуг на протяжении всего исследования.
- Выбирайте дозы ТХА на основании предшествующих доказательств и альтернативного режима дозирования, который может быть более целесообразным в догоспитальных и военных условиях.
- Группы хорошо сбалансированы по демографическим и исходным анатомическим / физиологическим характеристикам (за исключением меньшего количества проникающих повреждений в группе, получавшей только болюс).
- Тяжесть травмы в разных группах одинакова на основе оценки GCS, ISS и основного балла AIS.
- Первоначальный дизайн испытания заключался в сравнении каждой из двух схем дозирования ТХА отдельно с плацебо, но вместо этого было выполнено сравнение комбинированных групп ТХА с плацебо.
- 345 пациентов из 1280 (26,9%) подходящих пациентов не были включены в исследование из-за того, что набор TXA не был открыт.
- Экстренное снятие слепоты произошло у 3% пациентов, из которых 53% получили открытую ТХА.
- Завершение болюса составляло от 93 до 95%, а процент завершения дозы в стационаре был намного ниже — от 69 до 77%.
- Недостаточно побочных эффектов, чтобы сделать окончательные выводы о вреде ТХА только на основании этого исследования.
- Разница в ранней смертности, наблюдаемая между группами лечения, может привести к смещению выживаемости (пациенты с тяжелыми травмами, которые выживают дольше в группе, получавшей только болюс, возможно, прожили достаточно долго, чтобы испытать больше осложнений).
- 20% пациентов, включенных в исследование, при поступлении имели оценку по шкале GCS 13 или выше. Это может снизить общую тяжесть травмы, что приведет к смещению результатов, чтобы показать отсутствие разницы в результатах (т.е. более высокий балл по шкале GCS означает более высокую вероятность выздоровления независимо от лечения).
- 15% пациентов были потеряны для последующего наблюдения из-за прекращения исследования или невозможности найти пациентов.
- Неоднородность может потенциально существовать из-за включения тупых и проникающих повреждений (только 3% пациентов в этом испытании испытали проникающие повреждения).
- Несколько вторичных исходов сравнивали небольшое количество пациентов, что могло привести к ложным результатам.
- В настоящее время существует 2 РКИ по изучению использования ТХА у пациентов с ЧМТ, оба из которых не продемонстрировали статистически значимых различий в их первичных исходах при сравнении ТХА с плацебо.
- В текущем исследовании не изучались пациенты с менее тяжелой травмой, в отличие от CRASH-3. В исследовании CRASH-3 был значительно более низкий риск смерти от черепно-мозговой травмы у пациентов с менее тяжелыми травмами (от легкой до умеренной ЧМТ), получавших ТХА, по сравнению с плацебо.
- В этом испытании были изучены 2 различных режима дозирования ТХА и проведены исследовательские анализы на подгруппе пациентов с ВЧК. Статистически значимой разницы в прогрессировании ICH между пациентами, получавшими ТХА по сравнению с плацебо, в этом исследовании не наблюдалось.
- Использование шкалы GCS в качестве меры тяжести травмы ограничивает возможность отличить ICH от других депрессивных состояний ЦНС (т. е. интоксикации, седативного эффекта, шока). В это испытание было включено небольшое количество пациентов, у которых был ICH, который мог уменьшить различия в лечении.
- Неблагоприятные события, такие как судороги при применении ТХА, были зарегистрированы в предыдущих исследованиях. Хотя не было статистически значимой разницы в частоте приступов, наблюдалась тенденция к увеличению количества приступов при более высоких дозах ТХА (т. Е. В группе только болюсного введения) по сравнению с другими режимами. Слишком мало пациентов испытали какие-либо побочные эффекты, чтобы сделать значимые выводы об этом вреде.
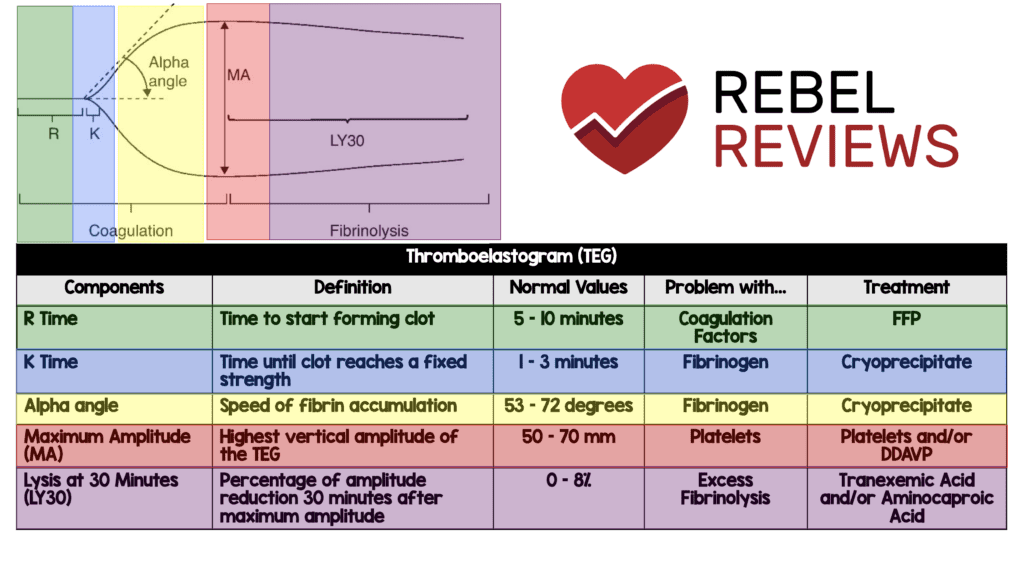
- ТЭГ был проведен при поступлении примерно у 80 пациентов в группе. Глядя на этих пациентов, мы ожидаем увидеть различие в Лизисе через 30 минут (LY30), где происходит избыточный фибринолиз. Нормальный диапазон для этого составляет от 0 до 8%. В этом испытании у пациентов, которым были нарисованы ТЭГ, мы видим более низкое среднее число в диапазоне во всех группах. Мы ожидаем, что это будет ниже в группах TXA (поскольку TXA ингибирует расщепление фибринового сгустка), чем в группах плацебо:
- Поддержание болюса: 0,3 (диапазон 0–1,2)
- Только болюс: 0,4 (диапазон 0–1,4)
- Плацебо: 0,4 (от 0 до 1,4)
- Показатели смертности в этом исследовании и CRASH-3 были примерно одинаковыми (≈20%), но пациенты в этом исследовании имели более тяжелую травму головного мозга по сравнению с CRASH-3 (GCS 13-15: 3% в текущем исследовании. против 28% в CRASH-3).
- Минимальная клинически значимая разница в травме головы — важный вопрос, на который пока нет ответа. В сопроводительной редакционной статье [2] авторы опускают этот момент. Например, разница в 1% может снизить смертность примерно на 560 смертей в год в США. Если мы воспользуемся разницей в 2,9% в этом исследовании, это снизит смертность на 1600 смертей в год в США.
- Разница в 3,5% результатов не была статистически значимой, но CRASH 2 привел к увеличению смертности на 1,5%. Очень вероятно, что реальная разница меньше 3,5%, но все же клинически важна и будет статистически значимой для большей группы пациентов. Даже снижение смертности на 1% было бы клинически важным для препарата без побочных эффектов
- Как и CRASH3, это испытание показывает, что TXA вряд ли может нанести вред больным ЧМТ, поэтому, если у вас ЧМТ и геморрагический шок, назначьте TXA.
- ТХА вводили большому количеству пациентов, у которых не было потенциальной пользы (409 человек или 43%) с отсутствием / минимальной травмой мозга или неизлечимой травмой. Кроме того, только 545 пациентов (56%) имели ICH на компьютерной томографии, которые потенциально могут выиграть от TXA, а остальные пациенты могут снизить результаты.



